肿瘤相关巨噬细胞(TAM)占肿瘤质量的50%,通过刺激血管生成、增加肿瘤细胞迁移和侵袭以及抑制抗肿瘤免疫导致恶性肿瘤进展[1]。但TAM同样具有高度可塑性,通过输送免疫因子、单克隆抗体、免疫激动剂等外源性物质将抗炎巨噬细胞极化为促炎巨噬细胞后即可达到抗肿瘤效果。但采取重编程策略的有效性通常难以保证 。
极化TAM的一种有效方式是依靠出血时浸润的红细胞(RBC)。巨噬细胞吞噬红细胞后将释放红细胞中的血红素,产生活性氧自由基(ROS)并引起巨噬细胞的M1极化,进而诱导TAM极化为促炎状态。利用红细胞极化巨噬细胞的关键在于如何特异性诱导肿瘤出血。出血部位和出血程度的难以控制,出血剂的长久毒性都限制了此种方法的应用。
活细菌被认为是一种有效的肿瘤靶向载体,基因改造可以帮助其精准靶向肿瘤细胞并成功定植和增殖。细菌鞭毛可以刺激单核细胞等细胞分泌TNFα,这将有效诱导肿瘤出血[2-5]。然而,虽然可以靶向肿瘤,但大量细菌的全身给药仍存在安全风险,并可能导致全身出血。如何在不影响正常凝血的情况下,选择精确诱导肿瘤出血的新材料仍存在挑战。
围绕上述问题,2023年6月13日,无锡市南京大学锡山应用生物技术研究所副所长、南京大学医学院教授吴锦慧带领团队取得重要进展,研究成果以“Flagella of Tumor-targeting Bacteria Trigger Local Hemorrhage to Reprogram Tumor-associated Macrophages for Improved Antitumor Therapy”为题,在Wiley杂志社出版的材料领域顶级学术期刊Advanced Materials上在线发表。吴锦慧教授团队通过基因工程构建了一种能够实现精确肿瘤出血的肿瘤靶向多鞭毛细菌(flhDC VNP)。flhDC VNP可以在肿瘤中定植,并过度表达鞭毛诱导TNFα产生,使肿瘤特异性出血。出血时浸润的红细胞使巨噬细胞暂时极化为M1表型。并在青蒿琥酯(Arts)的帮助下,由青蒿琥酯和血红素形成复合物,不断产生ROS使得暂时的极化转变为持续的极化(图1)。

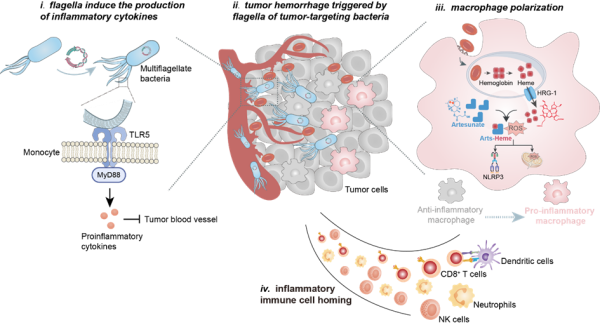
图1 多鞭毛细菌诱导肿瘤出血联合青蒿琥酯持续极化巨噬细胞(图源: Adv Mater. 2023)
团队首先通过基因工程技术构建了肿瘤靶向细菌(flhDC VNP)。VNP(减毒沙门氏菌)是一种兼性厌氧菌,更容易定植存活在免疫细胞功能受损的肿瘤微环境中。在VNP的基础上,flhDC VNP增强了产生鞭毛的能力(图2)这增强了其对细胞的侵袭能力 [6]。在肿瘤细胞中蓄积增加的flhDC VNP,促进了TNFα的表达,最终实现肿瘤内精准出血。在不影响正常组织凝血的同时也不会引起全身不良反应。

图2 多鞭毛细菌的构建与表征(图源: Adv Mater. 2023)
红细胞被巨噬细胞吞噬后会被消化产生血红素(Heme)。血红素与含有过氧桥的抗疟药物(例如Arts)发生反应将导致ROS的产生(图3)。因此,肿瘤靶向出血联合Arts的使用可以显著增加巨噬细胞内ROS水平。血红素和Arts结合的复合物还具有过氧化物酶活性,通过催化H2O2产生羟基自由基,同样可以增加细胞内ROS的产生。吞噬红细胞只能短暂的极化TAM而存在Arts时则可长期维持巨噬细胞的促炎表型。

图3 Heme与Arts结合产生ROS(图源: Adv Mater. 2023)
最后,团队研究细菌联合Arts的抗肿瘤作用。结果表明,flhDC VNP联合Arts对异种移植CT26结肠癌肿瘤、原位CT26结肠癌肿瘤和化疗耐药黑色素瘤均有抗肿瘤作用,并增强了TCR-T细胞治疗的抗肿瘤作用。
综上所述,该研究通过基因工程构建了一种多鞭毛细菌,靶向定植于肿瘤细胞后持续上调TNFα水平造成出血。TAM吞噬红细胞增加细胞内血红素含量。再通过青蒿琥酯与血红素的特异性结合产生ROS,从而持续极化TAM,重塑肿瘤免疫抑制微环境,改善抗肿瘤治疗。因此,活肿瘤靶向细菌的鞭毛可能为重编程TAM和改善抗肿瘤治疗开辟新的策略。
文章链接:https://doi.org/10.1002/adma.202303357
参考文献:
1. L. Cassetta, J. W. Pollard, Targeting macrophages: therapeutic approaches in cancer. Nat. Rev. Drug Discovery 17, 887-904 (2018).
2. J.-M. J. N. i. Reichhart, TLR5 takes aim at bacterial propeller. Nat. Immunol. 4, 1159-1160 (2003).
3. J. Chen, Y. Qiao, G. Chen, C. Chang, H. Dong, B. Tang, X. Cheng, X. Liu, Z. Hua, Salmonella flagella confer anti-tumor immunological effect via activating Flagellin/TLR5 signalling within tumor microenvironment. Acta Pharm. Sin. B 11, 3165-3177 (2021).
4. F. Ciacci-Woolwine, I. C. Blomfield, S. H. Richardson, S. B. J. I. Mizel, Salmonella flagellin induces tumor necrosis factor alpha in a human promonocytic cell line. Infect. Immun. 66, 1127-1134 (1998);
5. D. S. O'Mahony, U. Pham, R. Iyer, T. R. Hawn, W. C. J. I. j. o. m. s. Liles, Differential constitutive and cytokine-modulated expression of human Toll-like receptors in primary neutrophils, monocytes, and macrophages. Int. J. Med. Sci. 5, 1-8 (2008).
6. V. Raman, N. Van Dessel, C. L. Hall, V. E. Wetherby, S. A. Whitney, E. L. Kolewe, S. M. K. Bloom, A. Sharma, J. A. Hardy, M. Bollen, A. Van Eynde, N. S. Forbes, Intracellular delivery of protein drugs with an autonomously lysing bacterial system reduces tumor growth and metastases. Nat. Commun.12, 6116 (2021).
注:无锡市南京大学锡山应用生物技术研究所联合培养研究生野庆松为该论文的作者。该工作受到国家重点研发计划,国家自然科学基金的大力资助。